 教养
教养 环糊精的历史。Dexter French对环戊糖/环糊精和淀粉科学的贡献。
环糊精的历史。Dexter French对环戊糖/环糊精和淀粉科学的贡献。
 教养
教养  原料药
原料药  事件
事件 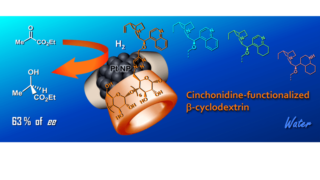 环糊精衍生物
环糊精衍生物  药物输送系统
药物输送系统 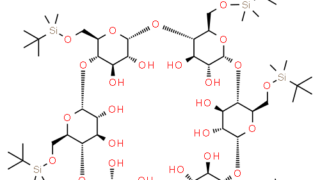 环糊精衍生物
环糊精衍生物  非药品应用
非药品应用  药物输送系统
药物输送系统  环糊精衍生物
环糊精衍生物  药物输送系统
药物输送系统