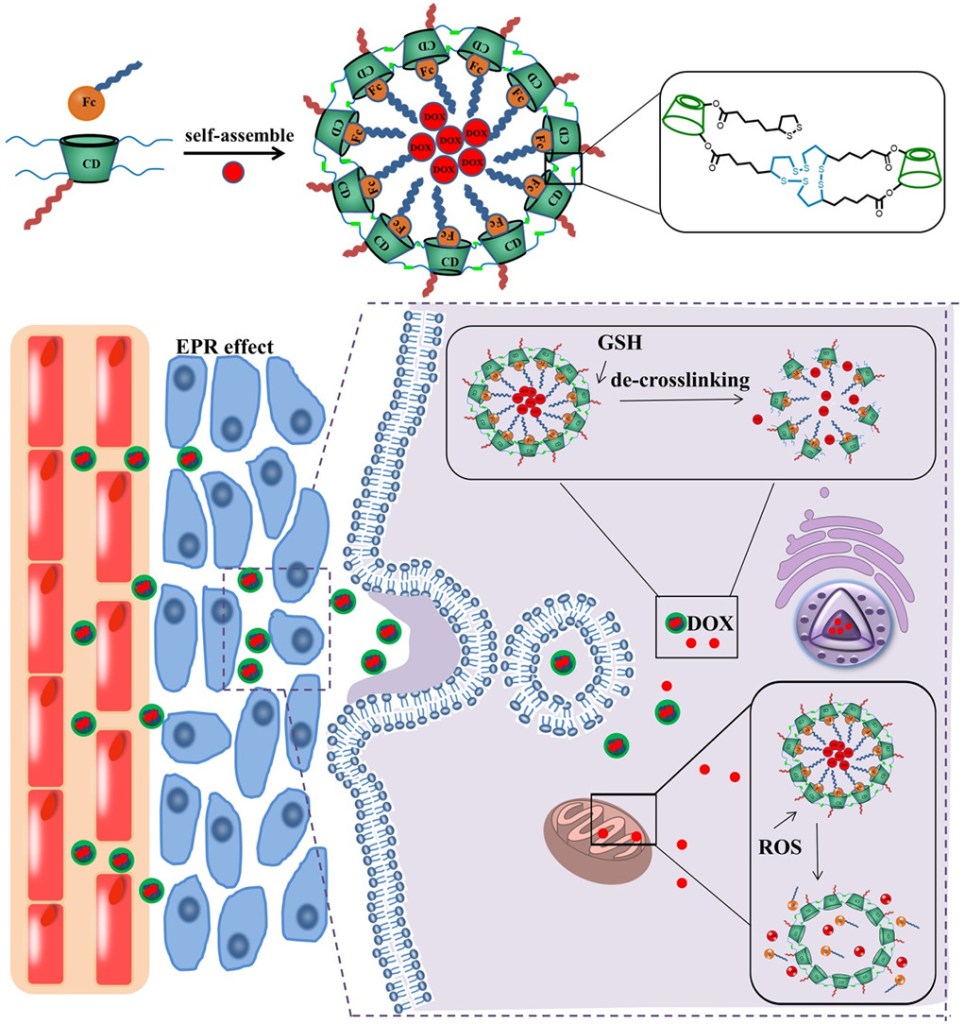
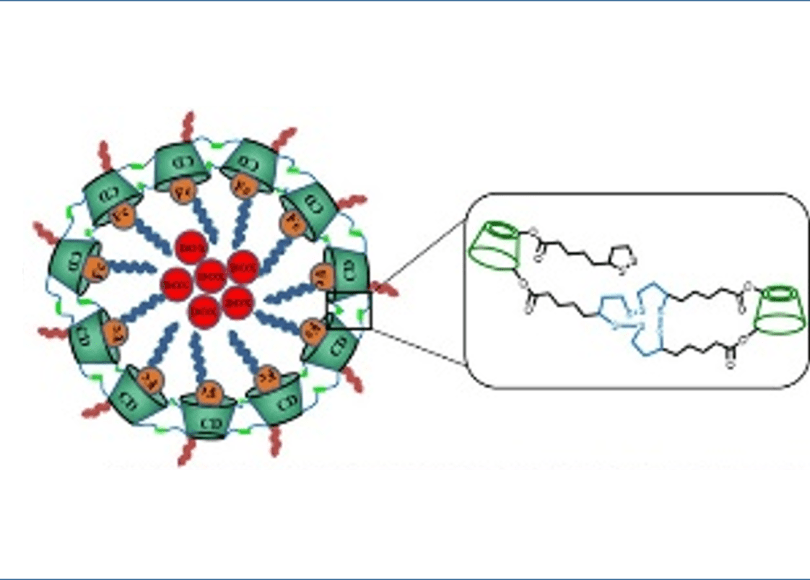
本研究では、酸化を媒介とした可逆的なフェロセンス(Fc)ゲスト分子との複合体形成のためのホストキャビティと、リポ酸(LA)で装飾された一次および二次フェースを統合した多機能β-CDユニットを自己架橋することにより、還元可能なジスルフィド結合によって可逆的にin-situ架橋することで、2つの酸化還元に敏感で安定化した超分子ナノコンテナーをワンポットで調製することを報告した。得られたドキソルビシン(DOX)を担持したナノ粒子は、架橋構造によりコロイド安定性が向上し、薬物担持率(DLC)が約11.3%と高い担持率を示した。一方で、細胞内のグルタチオン(GSH)と活性酸素種(ROS)を同時に取り込んで超分子ミセルをプログラム可能に破壊し、構造を完全に破壊して薬物放出を促進し、治療効果を高めることができた。特に、DOXをミセル化して最適化したDOX@CLP1は、Bel-7402がん肝細胞において、IC50が2.94±0.25μg/mLと、遊離のDOX(6.00±0.56μg/mL)よりも高い細胞毒性を示したが、L02正常肝細胞では遊離のDOXよりも副作用が有意に軽減された。さらに、Bel-7402腫瘍を持つBALB/cマウスを用いたin vivo動物実験では、このミセル構造体の消失半減期の延長、腫瘍への効率的な蓄積、治療効果の向上、全身毒性の低下が確認された。このように、本研究で開発された多機能CDユニットは、2つの酸化還元反応と安定化された超分子ナノコンテナーに関して、非常に簡単で堅牢な戦略を提供し、臨床応用に向けてプログラム可能な放出制御特性を持つ可能性がある。
Jinlei Peng, Ying Liu, Miao Zhang, Fangjun Liu, Liwei Ma, Cuiyun Yu, Hua Wei,
One-pot fabrication of dual-redox sensitive, stabilized supramolecular nanocontainers for potential programmable drug release using a multifunctional cyclodextrin unit,
Journal of Controlled Release, 2021, https://doi.org/10.1016/j.jconrel.2021.04.027.

コメント